Introducción
El 30℅ de las parejas que
recurren a las técnicas de reproducción asistida para conseguir un embarazo
presenta infertilidad masculina (Marzano et al., 2019). En la rutina de
laboratorio el estudio de la fertilidad masculina se realiza mediante la
evaluación de los parámetros establecidos por la Organización Mundial de la
Salud (OMS) como son volumen de eyaculado, concentración espermática,
morfología y motilidad (OMS, 2010) y según los valores obtenidos se recurre a
la aplicación de fecundación in vitro convencional (FIV) o inyección
espermática intracitoplasmática (ICSI). En este artículo vamos a realizar una
revisión de las técnicas de selección espermática disponibles para seleccionar
los espermatozoides con mejor calidad, desde las técnicas más convencionales
como gradientes y swim-up hasta las más novedosas como microfluídica o el uso
de progesterona.
Centrifugación por gradiente de
densidad
Swim-up
PICSI
Es una técnica basada en el uso
de ácido hialurónico (HA) como método de selección espermática. El ácido
hialurónico es un glicosaminoglicano que se encuentra presente tanto en el moco
cervical como en las células del cúmulo. Además, cabe destacar que los
espermatozoides presentan receptores para ácido hialurónico por lo que aquellos
que se unen a HA se encontrarán en estado de madurez, lo que permitirá que sean
usados en las técnicas de TRA. Se han
realizado varios estudios sobre la efectividad de esta técnica, entre ellos el
de Kim et al., 2019, donde se estudian 152 parejas con infertilidad masculina.
En este estudio la infertilidad se debía a teratozoospermia con menos de 1% de
espermatozoides con formas normales. De las 152 parejas, 77 fueron sometidas a
PICSI, es decir, selección de espermatozoides mediante HA y realización de
ICSI. Los resultados de este estudio muestran un aumento de las tasas de
fecundación y de embriones de buena calidad en comparación a la selección a
microscopio de solo por morfología y motilidad y realización posterior de ICSI.
Microfluídica
El método de
microfluídica está basado en el recorrido que deben realizar los
espermatozoides por el tracto genital femenino. De esta forma, se ha
desarrollado un chip compuesto de microcanales para seleccionar aquellos
espermatozoides que presentan mayor motilidad y menor porcentaje de anomalías,
como fragmentación del ADN. (Berguera et al., 2014). Los métodos de selección espermática mediante
microfluídica se pueden dividir según usen mecanismos activos o pasivos de
selección. Los métodos activos están basados en el uso de gradientes químicos,
electroforesis o flujos, mientras que los métodos pasivos seleccionan los
espermatozoides en base a su motilidad únicamente. Cabe destacar que esta
técnica es no invasiva y muestra mejores resultados en la vitalidad, motilidad
y morfología en comparación a las técnicas de centrifugación y swim-up. (Nosrati
et al., 2017).
Columnas de Anexina V (MACS)
MACS es una técnica que
consistente en la incubación de los espermatozoides con microperlas funcionalizadas con Anexina V. Durante esta incubación
aquellos espermatozoides que hayan externalizado fosfatidilserina en la
hemicapa externa de la membrana debido al inicio del proceso de apoptosis
quedarán unidos a estas microperlas. Tras la incubación la muestra pasará por
una columna con propiedades magnéticas donde los espermatozoides unidos a las
microperlas quedarán retenidos. De esta manera solo los espermatozoides no
unidos a la columna se usarán para fertilizar (Berguera et al., 2014).
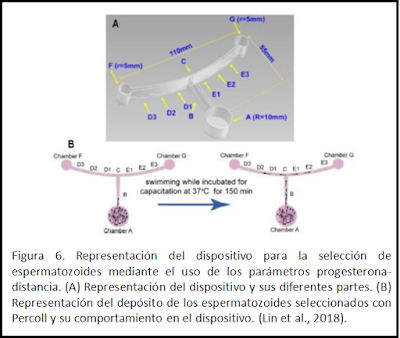
Progesterona-distancia
Lin
et al.,2019 han desarrollado un dispositivo basado en la distancia que deben
recorrer los espermatozoides desde la vagina hasta las trompas de Falopio y en
la quimiotaxis que sufren estos mediante la progesterona secretada por las
células del cúmulo durante el proceso de selección natural. La quimiotaxis
consiste en que los espermatozoides se mueven en la dirección de un gradiente
formado por una sustancia química o péptido, y solo los espermatozoides
capacitados responden a esta. Por lo tanto, los espermatozoides seleccionados
por quimiotaxis están capacitados y son de mejor calidad.
El dispositivo desarrollado está
formado por un cámara que simula la vagina (A) y dos cámaras que simulan los
ovarios (F y G). Los canales que comunican F y G simulan las trompas de
Falopio, quedando en el centro una cavidad que hace las veces de útero. En el
estudio realizado por Lin et al., 2019 se dispusieron las mezclas de agar y
quimioatrayentes (para simular el gradiente de progesterona) de la siguiente
forma: se establecieron tres surcos con agar entre el útero (C) y uno de los
ovarios (F) (D1, D2 y D3) y otros tres surcos entre C (útero) y G (ovario) (E1,
E2 y E3). Se depositó una solución control formada por 2% de agar y DMSO en el
surco D1 y una solución de 2% agar con 0.3 M de progesterona en E1. Tras
depositar semen seleccionado mediante gradiente de densidad en la cámara A se
les proporcionó 150 minutos para nadar y llegar a las cámaras más alejadas.
Tras este tiempo se hicieron las evaluaciones de morfología, dispersión de
cromatina y apoptosis. Tras la realización del experimento solo se encontraron
diferencias significativas entre la morfología de los espermatozoides del punto
E1 y D2, teniendo los del surco E1 mejor morfología.
Discusión
Cómo se ha descrito a lo largo de este artículo, existen
numerosas técnicas para la selección espermática. Las más usadas son la
centrifugación por gradiente de densidad y swim-up. Estas técnicas son poco
costas y rápidas de llevar a cabo, pero presentan el inconveniente de que
producen daños en el ADN espermático, tal y como recogen los trabajos
realizados por De Martin et al., 2017 y Muratori et al., 2019. Debido a este
inconveniente, se han desarrollado nuevas técnicas para poder seleccionar los
espermatozoides más viables, motiles y con mejor morfología. Son muchas las
técnicas desarrolladas como el uso de columnas de Anexina V, microfluídica y
PICSI, de las cuales se han realizado diferentes estudios con resultados
prometedores. En cuanto a la PICSI Nasr-Esfahani el al., 2008 informaron que
los espermatozoides seleccionados por esta técnica mostraron menos deficiencia
de protamina, fragmentación de ADN y morfología anormal en comparación con las
técnicas convencionales de selección espermática. Por otro lado, en el estudio
realizado por Troya & Zorrilla, 2015 se demostró que, en parejas
infértiles, la selección mediante el uso de columnas de Anexina V limita la
cantidad de esperma seleccionado que presenta ADN dañado, lo que condujo a
mejores tasas de embarazo clínico en comparación con ICSI convencional y PICSI.
Una de las técnicas más novedosas de selección espermática es la microfluídica.
Esta técnica se presenta como una potente alternativa a swim-up y a la
centrifugación por gradiente densidad, tal como se explica en los trabajos de
Shirota et al., 2016 y Nosrati et al, 2017. Finalmente, cabe destacar la
creación de una nueva técnica de selección espermática basada en el uso de un
gradiente quimiotáctico de progesterona y en imitación de la distancia que
deben recorrer los espermatozoides por el tracto genital femenino. Con esta
técnica, desarrollada por Lin et al, 2018 se consigue seleccionar
espermatozoides de mejor morfología y con menos fragmentación del ADN, por lo
que se presenta como una muy buena técnica para la selección espermática, pero
aún deben realizarse más estudios con mayor número de pacientes y diversas
causas de infertilidad para comprobar su verdadera eficiencia.
Podemos concluir que, pese al gran número de técnicas
desarrolladas para la selección espermática, aún no se ha desarrollado aquella
que destaque en sus resultados por encima de las demás, todas poseen sus
ventajas e inconvenientes, siendo algunas de ellas demasiado recientes como
para poder obtener alguna conclusión en firme sobre su efectividad en clínica.
Bibliografia
Berguera, A., de la Orden Rodríguez, M., Martínez, J. V.,
Fernández, P. J. & Rubio, J. M. (2014). Evaluación de dos métodos de
capacitación espermática (swim-up y gradientes) mediante el estudio de la
morfología, madurez y fragmentación del DNA de los espermatozoides en muestras
destinadas a IA. Revista Asebir. Recuperado de: https://revista.asebir.com/evaluacion-de-dos-metodos-de-capacitacion-espermatica-swim-
upy-gradientes-mediante-el-estudio-de-la-morfologia-madurez-y-fragmentacion-del-dna-de-losespermatozoides-en-muestras-destinadas-a-ia/
Kim, S.J., Kim, H., Kim, T.H.,
Jeong, J., Lee, W.S. & Lyu, S.W. (2019). Effect of sperm selection using hyaluronan on
fertilization and quality of cleavage-stage embryos in intracytoplasmic sperm
injection (ICSI) cycles of couples with severe teratozoospermia. Gynecological Endocrinology. https://doi.org/10.1080/09513590.2019.1681960
Lin K., L R., Ni Y., Sun P., Liu Y., Zhang D & Huang H.
(2018). Novel distance‑progesterone‑combined
selection approach improves human sperm quality. Journal of Translational Medicine 16:203. https://doi.org/10.1186/s12967-018-1575-7
Marzano, G., Chiriacò M.S., Primiceri, E., Dell’Alquila, M.E.,
Ramalho-Santos,J., Zara, V., Ferramosca,A & Mauriccio, G. (2019). Sperm
selection in assisted reproduction: A review of established methods and cutting-edge
possibilities. Biotechnology Advances. https://doi.org/10.1016/j.biotechadv.2019.107498
Muratori M,
Tarozzi N, Carpentiero F, Danti S, Perrone FM, Cambi M, Casini A, Azzari C,
Boni L, Maggi M, Borini A & Baldi E. (2019). Sperm selection with density
gradient centrifugation and swim up: efect on DNA fragmentation in viable
spermatozoa. Scientific Reports 9,
7492. https://doi.org/10.1038/s41598-019-43981-2
Nasr-Esfahani,
M.H., Razavi, S., Vahdati, A.A., Fathi & F. Tavalaee, M. (2008). Evaluation
of sperm selection procedure based on hyaluronic acid binding ability on ICSI
outcome. J Assist Reprod Genet, 25(5),
197-203. https://doi.org/10.1007/s10815-008-9223-4
Nosrati, R., Graham, P.J., Zhang, B., Riordon, J.,
Lagunov, A., Hannam, T.G., Escobedo, C., Jarvi, K & Sinton, D. (2017). Microfluidics
for sperm analysis and selection. Nature
Reviews Urology, 14(12), 707-730. https://doi.org/10.1038/nrurol.2017.175
Troya, J. & Zorrilla, I. (2015). Annexin V-MACS
in infertile couples as method for separation of sperm without DNA
fragmentation. JBRA Assist Reprod, 19(2),
9-66. https://doi.org/10.5935/1518-0557.20150015
Shirota, K., Yotsumoto, F., Itoh, H., Obama, H.,
Hidaka, N., Nakajima, K. & Miyamoto, S. (2016). Separation
efficiency of a microfluidic sperm sorter to minimize sperm DNA damage. Fertiliy
and Sterility, 102(2),
315-321. https://doi.org/10.1016/j.fertnstert.2015.10.023.





Un tema interesante y que se ha actualizado bastante en los últimos años. El principal problema que en su mayor parte es un calco del artículo original, a veces rozando el plagio... deberíais volver sobre él y repensarlo utilizando una base bibliográfica más amplia. No está mal que os baséis en un solo artículo (que es muy interesante), pero el trabajo debéis desarrollarlo desde vuestro propio punto de vista. Creo que este dispositivo debería ser uno de los que tratéis, pero tal vez compararlo con otros, hacer un estudio crítico de sus posibilidades, etc. El trabajo carece de una parte de discusión o crítica apropiada sobre la bibliografía, simplemente hay una relación de resultados.
ResponderEliminarOs pongo algunas notas, pero deberíais trabajarlo bastante.
De hecho, hay un error muy importante. El Percoll hace tiempo que no se utiliza por problemas que se descubrieron en los 90:
Pharmacia Biotech: Important notice: Percoll® NOT to be used in Assisted Reproduction Technologies in Humans. Pharmacia Biotech Inc, December 12, 1996
Claassens, O. E, R. Menkveld, y K. L Harrison. 1998. «Evaluation of three substitutes for Percoll in sperm isolation by density gradient centrifugation». Hum Reprod 13 (11): 3139-43.
Tened en cuenta que el Percoll y otras marcas comerciales se escriben con mayúscula.
Revisad para corregir expresiones raras ("sustancia química o péptido", "De esta manera consiste en"). Intentad utilizar expresiones sencillas y vigilad que no sean innecesarias o redundantes.
En algún caso el texto es algo confuso. Por ejemplo, en el primer párrafo de Resultados, utilizáis "semen" en lugar de "espermatozoides", al utilizar el pronombre "les". En textos científicos no temáis repetir términos si esto ayuda a eliminar ambigüedad.
Deberíais dar un repaso a la estructura de los párrafos. A veces se mezclan ideas. Por ejemplo, en el 3 se empieza hablando de la microfluídica, luego se salta a la Anexina V. Esto rompe la estructura del texto, que debería conducir directamente al párrafo final (relacionado con la microfluídica). La última frase de la introducción sería mejor si la planteáseis como "Lit et al. (2018) han diseñado recientemente...".
Las figuras están bien elegidas, aunque un poco más de tamaño ayudaría (tenéis margen).
Considerad estos comentarios junto con los del artículo divulgativo. Son trabajos distintos, y por tanto los principales defectos en éste no lo son en el otro.
Buenos días Felipe, hemos subido de nuevo el artículo científico dándole una nueva visión para así corregir todos los puntos que nos indica en su comentario.
ResponderEliminar