La
predeterminación del sexo es un medio atractivo para controlar la proporción de
sexos en una población determinada de animales de producción o de la fauna
salvaje. El sexado de
espermatozoides de mamíferos mediante citometría de flujo para su uso en inseminación
artificial (IA) o fecundación in vitro
(IVF) ha dado lugar al nacimiento de cientos de miles de descendientes en
numerosas especies y sigue siendo el único método científicamente probado para
la selección del sexo en el momento de la concepción. El sexado del semen se puede realizar debido
a la diferencia en el contenido de ADN total entre los espermatozoides que
llevan el cromosoma X (de mayor tamaño) y los que llevan el cromosoma Y (más
pequeño). Para lograr la selección,
los espermatozoides se tiñen con un colorante que permite que el citómetro de
flujo detecte la diferencia de ADN y separarlos en dos poblaciones distintas. En casos como el del toro, el esperma con el
sexo seleccionado suele ser criopreservado para su posterior utilización
en IA. En referencia a las vacas
lecheras, donde interesa sexar el esperma con el fin de obtener un mayor número
de hembras (productoras de leche), existen discrepancias entre: las ventajas de la determinación
del sexo, el método por el cual los espermatozoides son sexados y los efectos
del proceso de clasificación en la viabilidad de los espermatozoides y la
fertilidad. Se discuten además
las distintas vías por las cuales semen sexado puede ser difundido, así como el
estado del esperma después de someterlo a técnicas de criopreservación.
El uso de espermatozoides seleccionados en función del sexo representa una importante ayuda para la recuperación de pequeñas poblaciones de animales, sesgando la población hacia hembras para poder producir más individuos de la especie. Además, en poblaciones en las cuales la proporción de uno de los sexos pueda dejar en desventaja al otro, este problema puede verse solucionado mediante esta técnica de selección. A pesar de estas ventajas de estabilidad reproductiva y social de los programas de IA utilizando espermatozoides sexados y la eficacia demostrada de estas tecnologías en el delfín mular (Tursiops truncatus) comprobadas en múltiples acuarios, la falta de experiencia y los gastos asociados con el proceso de clasificación han frenado su uso. Sería interesante que se ofrecieran más oportunidades en zoológicos para poder mejorar la técnica y ampliar conocimientos. Por otro lado, la disminución en los costes de producción se basa en la disminución de la dosis mínima efectiva para la inseminación. Actualmente, en el caso del delfín mular, se recomienda usar 200 millones de espermatozoides con motilidad progresiva. En otras especies ya se había logrado disminuir la dosis de IA utilizando otro tipo de técnicas de inseminación intrauterinas. Estos métodos se basan en el uso de un endoscopio o un catéter diseñado para depositar el semen cerca o en la misma unión Útero-tubárica (UTJ), en lugar de hacerlo en el cuerno uterino caudal como en la IA convencional.
El sexado por citometría de flujo es un
proceso de separación basado en la diferencia en la cantidad de ADN entre los
cromosomas X e Y [4]. La diferencia en el contenido de ADN
entre los espermatozoides bovinos que llevan el cromosoma X es 3,8% más con
respecto al cromosoma Y [3]. En humanos esta diferencia es de un 2,8% y en la
mayoría de los mamíferos están en el rango de 3-4,5 % aproximadamente [13]. El cromosoma X es mayor que el Y debido a una mayor cantidad de
cromatina heteróloga.
El
proceso consiste en el paso de espermatozoides a través de un detector como el
citómetro de flujo el cual mide la intensidad de fluorescencia resultado de la
excitación de las moléculas de colorante ligado al ADN. Usualmente es generado
por un láser y la intensidad de fluorescencia obviamente depende del número de
moléculas fluorescentes unidas al DNA [9].
 |
| FIGURA 1. ESQUEMA BÁSICO DEL FUNCIONAMIENTO DE UN CITÓMETRO DE FLUJO |
La intensidad de la luz UV afecta al ADN de los espermatozoides, específicamente a la motilidad de los espermatozoides. En un estudio se uso el colorante Hoeschst 33242. Éste colorea el ADN de manera eficiente y causa menor daño tanto a la morfología como a la motilidad del espermatozoide ya que reduce la intensidad a la que actúa el láser [11].
Un
factor negativo de la técnica es la cantidad de espermatozoides que se ven dañados
durante el proceso, que fluctúa en torno al 70% de los espermatozoides, que
fallan al ser clasificados debido al daño o por la ausencia de distinción al
pasar por el citómetro [7]. Además, el campo electrostático, al que
se ven sometidos, les produce varios daños como pueden ser: la creación de poros
en la membrana, disminuyendo así su capacidad de fecundación,una mayor formación
de especies reactivas de oxigeno (ROS), dañando aún más sus membranas, y
defectos en la cola, afectando a su motilidad.
Una
de las mayores limitaciones de la citometría de flujo es la tasa de
clasificación, lo que significa que animales inseminados con semen sexado
tienden a recibir menor concentración de espermatozoides por dosis que los
animales que experimentan una IA con semen entero. El número de espermatozoides
utilizado en la práctica habitual es de 20 x 106 espermatozoides por
dosis.
En este
artículo nos vamos a centrar en el estado actual de la tecnología de separación
del semen en la naturaleza, haciendo hincapié a las implicaciones en la gestión
y conservación de las especies, centrándonos sobre todo en el delfín mular (Tursiops truncatus).
Exceptuando el volumen de la cabeza del espermatozoide, la única diferencia entre poblaciones de espermatozoides que pueda ser medible y científicamente válida es el contenido de ADN. Como ya hemos mencionado, el cromosoma X de los mamíferos tiene más ADN que el cromosoma Y, siendo esta diferencia la base para la separación de los espermatozoides por citometría de flujo. La técnica analiza cuantitativamente el contenido de ADN y proporciona un método fiable para la identificación y separación de las poblaciones de espermatozoides X e Y. La pureza de más del 90% del sexo deseado se puede lograr utilizando la tecnología de clasificación de esperma actual. El desarrollo de los citómetros de flujo de alta velocidad (MoFlo ® SX, Dako, Fort Collins, CO, USA) y la mejora de los sistemas de orientación celular ha dado lugar a grandes aumentos en la eficiencia de la clasificación y calidad del esperma.
Exceptuando el volumen de la cabeza del espermatozoide, la única diferencia entre poblaciones de espermatozoides que pueda ser medible y científicamente válida es el contenido de ADN. Como ya hemos mencionado, el cromosoma X de los mamíferos tiene más ADN que el cromosoma Y, siendo esta diferencia la base para la separación de los espermatozoides por citometría de flujo. La técnica analiza cuantitativamente el contenido de ADN y proporciona un método fiable para la identificación y separación de las poblaciones de espermatozoides X e Y. La pureza de más del 90% del sexo deseado se puede lograr utilizando la tecnología de clasificación de esperma actual. El desarrollo de los citómetros de flujo de alta velocidad (MoFlo ® SX, Dako, Fort Collins, CO, USA) y la mejora de los sistemas de orientación celular ha dado lugar a grandes aumentos en la eficiencia de la clasificación y calidad del esperma.
El uso de la citometría de flujo para sexar espermatozoides frescos y obtener descendencia del sexo determinado se realizó por primera vez en conejos por el equipo de LA. Johnson en 1989. Desde entonces la técnica ha avanzado mucho y se han obtenido descendiente utilizando semen sexado en fresco o congelado, asociándolo a las técnicas de reproducción asistida (TRA) en humanos y en animales(tanto domésticos como es especies salvajes en peligro de extinción). En la especie que nos interesa, el primer delfín mular nació en el año 2005 a cargo del equipo de J.K. O’Brien y T.R Robeck. Ellos llevaron a cabo una investigación para desarrollar la clasificación del semen y metodologías de conservación novedosas para la predeterminación del sexo en el delfín mular, utilizando la IA. Realizaron varios estudios en los que comprobaron: el efecto que tiene el plasma seminal, la concentración de espermatozoides y la velocidad de congelación en la calidad de los espermatozoides in vitro.
Durante más de treinta años se han estado buscando herramientas
para garantizar la sostenibilidad a largo plazo de la población ex situ de delfines mulares. Las TRA son
un componente clave de este grupo de herramientas de gestión e incluyen la
congelación de semen, inseminación artificial (IA) y la preselección del sexo
mediante citometría de flujo.
Se llevó a cabo un
estudio para tratar de probar este sistema en la especie de delfines Tursiops truncatus. Los objetivos de la investigación eran:
·
Desarrollar y describir los métodos de para realizar la IA
(profundidad de deposición del semen, el sexado, las dosis).
·
Comparar la calidad espermática diferenciando el semen sexado y el
no sexado.
·
Examinar las tasa de embarazo y los partos obtenidos mediante la
realización de IA por medio de tres grupos (semen no sexado, semen sexado en
pequeña dosis, semen sexado usando la dosis estándar).
En el estudio utilizaron una
muestra de 39 hembras obtenidas de diferentes centros zoológicos del mundo que
tenían edades mayores de 6 años y pesaban menos de 180 kg. Por otro lado, el
tamaño muestral de macho fue de 12, también recogidos de distintas zonas del
mundo, y las edades estaban comprendidas entre los 10 y 35 años, con pesos
menores a 200 kg. Se alojaron a los individuos en unas piscinas especiales y fueron alimentados
de acuerdo a su peso corporal.
Se realizó un seguimiento
endocrino recogiendo las muestras de orina. Se siguieron: el estudio de LH
(mediante inmunoensayo EIA por análisis retrospectivos), creatinina, conjugados
de estrógenos urinarios (mediante ensayo enzimático), y progesterona.
Se intentó además sincronizar el día de la ovulación para programar la IA de la manera más adecuada. Mediante ecografía se vio en detalle la actividad folicular y después se usó para confirmar el embarazo.Los varones fueron capacitados para la eyaculación. Se analizó: la concentración, volumen, motilidad espermática y la integridad de la membrana plasmática utilizando técnicas estandarizadas [6]. Las suspensiones de esperma de cada macho se diluyeron a 200-400 x 106 espermatozoides/ml con medio HEPES-TALP, añadiendo antibiótico (sulfato de estreptomicina) y sometiéndolo a incubación. Mediante citometría de flujo de alta velocidad fueron obteniendo la separación de los espermatozoides portadores de cromosoma X y portadores de cromosoma Y. Posteriormente se criopreservaron y descongelaron para su uso. Por otro lado, el semen no sexado también fue criopreservado y posteriormente descongelado utilizando bolitas o pajuelas de 0,5ml.
Se intentó además sincronizar el día de la ovulación para programar la IA de la manera más adecuada. Mediante ecografía se vio en detalle la actividad folicular y después se usó para confirmar el embarazo.Los varones fueron capacitados para la eyaculación. Se analizó: la concentración, volumen, motilidad espermática y la integridad de la membrana plasmática utilizando técnicas estandarizadas [6]. Las suspensiones de esperma de cada macho se diluyeron a 200-400 x 106 espermatozoides/ml con medio HEPES-TALP, añadiendo antibiótico (sulfato de estreptomicina) y sometiéndolo a incubación. Mediante citometría de flujo de alta velocidad fueron obteniendo la separación de los espermatozoides portadores de cromosoma X y portadores de cromosoma Y. Posteriormente se criopreservaron y descongelaron para su uso. Por otro lado, el semen no sexado también fue criopreservado y posteriormente descongelado utilizando bolitas o pajuelas de 0,5ml.
Para la inseminación artificial
se tuvo que tratar con diazepan a las hembras para tranquilizarlas. La inseminación fue el paso más complicado del proceso, ya que se encontraron con muchas barreras
anatómicas como el pliegue
espermatecal (pseudocérvix), el orificio
cervical externo, el orificio cervical interno, la bifurcación uterina y la
UTJ.
Las
deposiciones del semen que se realizaron fueron:
·
Semen no sexado (gran dosis) depositado en el
cuerno uterino, en 9 de las hembras.
·
Semen sexado (dosis estándar) depositado a la
mitad del camino dentro de uno o ambos cuernos uterino, en 20 hembras.
·
Semen sexado (pequeña dosis) concentrado por centrifugación después de su
descongelación y depositado en UTJ, en 20 hembras.
Se diagnosticó un
embarazo a los 28 días post-IA determinando la concentración de progesterona (superior
a 5 ng /ml). Después, se realizaron ecografías para la confirmación y
seguimiento de la preñez.
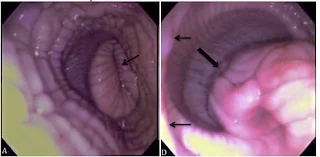 |
| FIGURA 3. BARRERAS ANATÓMICAS VAGINALES ENCONTRADASAL REALIZAR LA INSEMINACIÓN [1] |
Se
encontraron con muchas barreras anatómicas importantes
durante los procedimientos de inseminación que incluyen el pliegue
espermatecal (pseudocervix), orificio cervical externo, orificio cervical
interno, bifurcación uterina y la UTJ. El paso a través del orificio cervical
representó la parte más complicada del procedimiento.
 |
| TABLA 1. EDAD, CARACTERÍSTICAS DEL CICLO ESTRAL Y PARÁMETROS REPRODUCTIVOS DEL DELFÍN NARIZ DE BOTELLA (TURSIOPS TRUNCATUS) [1] |
Este estudio sirvió para examinar los factores que afectan a la fertilización en el delfín mular con espermatozoides sexado y no sexados. Permitió también obtener nuevos datos acerca de la anatomía reproductiva y de perfiles endocrinos que ayudaron a perfeccionar las bases de datos sobre esta especie.
Para delfines menores de 25 años, la tasa de embarazo se mantuvo incluso cuando se reducía cuatro veces la dosis de semen sexado usado en la IA y, teniendo en cuenta además, el lugar de deposición. Son necesarios aun más estudios para poder confirmar con mayor seguridad que puede haber tasas de embarazo con bajas dosis de semen sexado.Se consiguió el nacimiento de 11 crías, habiendo sido obtenidas el 91% de ellas a partir de semen sexado, lo que pone de manifiesto la eficacia de la citometría de flujo como una herramienta adecuada para el mantenimiento de la ratio de sexos en poblaciones de delfín mular.
Aunque la senescencia reproductiva o disminución del éxito reproductivo con la edad se ha demostrado en delfines y otras especies de mamíferos, la contribución de aborto espontáneo a esta disminución se ha documentado recientemente y con esta investigación se ha vuelto a confirmar. En un estudio retrospectivo, se vio que mujeres sometidas a FIV que eran mayores de 35 años tenían casi el doble de incidencia de aborto espontáneo (35%) que las mujeres menores de 35 (22%) [8]. En vacas también hay estudios que corroboran estos resultados. Se cree que un factor clave para esta pérdida es la baja funcionalidad del cuerpo lúteo, que resulta en la secreción inadecuada de progesterona para el desarrollo de las glándulas secretoras, lo cual es esencial para sostener al embrión temprano. La suplementación con progesterona durante las primeras etapas del embarazo es una práctica muy común en la clínica humana y en algunas especies domésticas, ya que está considerada como un buen método para combatir los abortos en las etapas tempranas.
Los resultados de este estudio demuestran la eficacia de la selección de esperma y la IA para la gestión de proporción de sexos en las poblaciones de delfines mulares.Las tasas de embarazo son mayores con espermatozoides sexados. Esto podrá reducir costes en la producción de crías de sexo deseado y mejorar el manejo de esta técnica en las poblaciones de delfines.
La reducción de las tasa de aborto en hembras menores de 25 años nos indica que es adecuado seleccionar las hembras a las que se les va a realizar la IA para aumentar así la eficacia de los programas utilizando los espermatozoides sexados.
Isabel Gutiérrez Díaz
Isabel M Sánchez
Castelló
BIBLIOGRAFÍA
1. Robeck, T. R. et al. Development and evaluation of deep intra-uterine artificial insemination
using cryopreserved sexed spermatozoa in bottlenose dolphins (Tursiops
truncatus). Anim. Reprod. Sci. 139, 168–181
(2013).
2. O’Brien, J. K. & Robeck, T. R. The relationship
of maternal characteristics and circulating progesterone concentrarions with
reproductive outcome in the bottlenose dolphin (Tursiops truncatus) after
artificial insemination, with and without ovulation induction, and natural
breeding. Theriogenology, 78, 469-482 (2012)
3. O’Brien, J. K., Steinman, K. J. & Robeck, T. R.
Application of sperm sorting and associated reproductive technology for
wildlife management and conservation. Theriogenology 71, 98–107 (2009).
4. Grant V, Chamley L. Sex-Sorted Sperm and Fertility:
An alternative view. Biol Reprod.,76, 184-188 (2007)
5. O’Brien, J. K. & Robeck, T. R. Development
of sperm sexing and associated assisted reproductive technology for sex
preselection of captive bottlenose dolphins (Tursiops truncatus). Reprod.
Fertil. Dev. 18, 319–329 (2006).
6. Robeck T.R et al. Estrous cycle characterisation and artificial inseminaton using
frozen-thawed spermatozoa in the bottlenose dolphin (Tursiops truncatus).
Reproduction, 129, 659-674 (2005)
7. Weigel K. Exploring the role of sexed semen in
dairy production systems. J. Dairy Sci. 87, 120-130 (2004)
8. Rochebrochard E., Thonneau P. Paternal age and
maternal age are risk factors for miscarriage; results of muticentre European
study. Hum. Reprod, 17, 1649-1656 (2002)
9. Garner D, Seidel Jr. Current Status of Sexing
Mammalian Spermatozoa, Reproduction 124, 733-743 (2002)
1
10. Brook F.M . Ultrasonographic imaging of the
reproductive organs of the female bottlenose dolphin, Tursiops truncatus
aduncas. Reproduction, 121, 419-428
(2001).
11. Garner D. Sex-Sorting Mammalian Sperm: Concept to Application in Animals. J
Andrology. 22, 4 (2001).
11. Garner D. Sex-Sorting Mammalian Sperm: Concept to Application in Animals. J
Andrology. 22, 4 (2001).
12. Mann J., Connor R.C. , Barre L.M ,
Heithaus M.R. . Female reproductive success in bottlenose dolphins (Tursiops
sp.) : life history, habitat, provisioning, and group-size effects. Behav.Ecol. 11, 210-219 (2000)
13. Johnson L. Sexing mammalian sperm for production
of offspring: the state-ofther-art. Anim Reprod Sci 60-61, 93-107
(2000).
14. L. Cornell, E. Asper, J. Antrim, S. Searles.
Progress report: Results of a long-range captive breeding program for the
botlenose dolphin, Tursiops truncatus gilli. Zoo Biol. 41-53 (1987)
15. H.Marsh, T. Kasuya. Evidence for reproductive
senescence in female cetaceans. Rep.Int.Whal. Comn., 8, 57-74 (1986).

.jpg)
Buen artículo. Creo que se describe bastante bien la situación de la técnica en los delfines y los avances realizados.
ResponderEliminarUn par de puntualizaciones al principio. Realmente hay otros métodos científicamente probados, pero lo que sucede es que no dan un rendimiento suficiente (suelen estar entre el 60%-70%). También deberíais indicar que la diferencia en ADN entre X e Y varía entre especies (lo comentáis a continuación, pero es mejor si lo dejáis claro desde el principio, o no dar detalles). Al final usáis "Se discuten". ¿Os referís a que hay debate sobre este tema, o a que lo vais a tratar en el artículo? Evitad el impersonal. Se usa bastante en algunos textos y conferencias, pero no es lo más adecuado.
Revisad la puntuación, en algún sitio os hacen falta comas. En algún sitio usáis punto y coma, pero creo que es más adecuado si usáis comas (lo mejor es poner dos puntos antes de la enumeración, si queréis usar punto y coma).
No uséis "fuerza" como sinónimo de "intensidad" en fluorescencia. No os preocupe repetir términos, estáis usando un registro científico, y lo importante es que el término quede claro.
Aseguraos de que las imágenes queden a buena resolución. Id al sitio donde las habéis conseguido, a ver si las podéis descargar a buen tamaño, y no las comprimáis mucho. Colocadlas en el texto de manera que se vean bien, no pasa nada si ocupan toda la anchura de la columna.
Justo después de la imagen, habláis de que se han usado métodos como la exposición a luz UV. ¿A qué método os referís? No citáis estudio, y por citometría se usa un láser UV, precisamente.
Veo que usáis un sistema de citas numérico, pero no veo más citas después de la foto del delfín.
Creo que hay algunos párrafos que deberíais mover al principio. Cuando empezáis a hablar del caso concreto del delfín, hay un par de párrafos en los que volvéis al tema general ("El uso de espermatozoides seleccionados en función del sexo representa una importante ayuda para la recuperación de pequeñas poblaciones de animales…"). Creo que ese texto queda mejor en la introducción, donde habláis del sexado en general.
En la frase "Se alojaron en unos medios específicos" ¿a qué os referís? ¿A piscinas apartadas?
Hemos realizado los cambios que nos has recomendado.
ResponderEliminar1. Hemos quitado la referencia a las diferencias de DNA del principio y hemos dejado la explicación posterior.
Hemos intentado eliminar el impersonal, aunque no se si nos habremos saltado alguno. Por favor si lo ves avisanos que lo cambiamos.
2. Hemos eliminado los puntos y coma y añadido los dos puntos como nos comentaste. Además hemos revisado el uso de las comas en todo el texto.
3. La intensidad de la fluorescencia.
4. Las imagenes las hemos aumentado, espero que se vean un poco mejor aunque la resolución de la tabla de resultados no se porqué pero sigue sin verse totalmente bien.
4. Lo de la luz UV nos referíamos al daño que produce y a un experimento que habíamos encontrado. está en la bibliografía e indicado en su correspondiente posición en el texto
5. Después de la foto del delfín había otras dos citas. He puesto todo a negrita por si no se veían correctamente.
6. Hemos movido algín párrafo al principio, a la introdución.
7. En la frase de "alojados en medios específicos" me refería, como tú bien comentas, a unas piscinas en las que colocaron a los delfines para realizar el experimento.
Esperamos haber realizado los cambios convenientes. De todos modos, si nos hemos olvidado de algo o hay algo que te parezca mejor de otra manera no dudes en decirnoslo.
Muy bien. Es posible que la tabla original tenga ya mala calidad, no obstante creo que se ve. De todas maneras, ¿cómo la habéis generado? Parece que hay varias cosas mezcladas, y algunas traducciones raras (mujeres, terneras, etc.). En cualquier caso, deberíais poner una leyenda a cada figura y tabla, describiéndolos brevemente y citando el trabajo o web del que lo habéis sacado.
ResponderEliminarLo de la luz UV sigue sin estar claro. Yo creo que os referís a los trabajos en los que se ha ajustado su intensidad, y que al usar Hoechst (33342, hay muchos tipos de Hoechst) se puede reducir la intensidad del láser. Pero en el párrafo mezcláis varias cosas inconexas y no tiene mucho sentido, es casi la única pega al artículo:
"La utilización de luz ultravioleta se sabe que causa daños en el DNA, viéndose afectada la motilidad de los espermatozoides sexados . Se suele usar el colorante Hoechst 33342, el cual colorea el ADN eficientemente y con menos daño en la morfología y motilidad del espermatozoide [11]. Es por esto que la citometría de flujo se ha convertido en el método más adecuado para la separación de espermatozoides con cromosomas X e Y."
Ya hemos puesto las leyendas en todas las fotos, sobre todo indicando a que artículo pertenecían la tabla y las fotografías de las barreras anatómicas.
ResponderEliminarLa traducción de la tabla no estaba correcta, con lo cual, hemos decidido poner la misma tabla pero en inglés, en el idioma del artículo.
Respecto a lo de la luz UV , hemos revisado los artículos y la información que teníamos y si se refería a la intensidad de luz. El articulo del uso de Hoeschst es para evitar que se dañe tanto el ADN.
Si tienes alguna indicación más que comunicarnos, estaremos atentas
Vale, creo que queda mejor así.
ResponderEliminar