Olaia Akesolo Atutxa, Rocío García Corbeto, Adriana Rodríguez Cortina
1. INTRODUCCIÓN
El tabaquismo sigue siendo una práctica común en todo el mundo. De hecho, según la Organización Mundial de la Salud (OMS), aproximadamente un tercio de la población mayor de 15 años es fumadora. Varios estudios han revelado que el humo de los cigarrillos contiene alrededor de 4.000 sustancias químicas nocivas (entre ellas, sustancias mutagénicas y carcinógenas). Además, muchas de estas sustancias químicas son especialmente perjudiciales, como la nicotina y su metabolito, la cotinina, así como el polonio radiactivo y el cadmio [1].
El consumo de tabaco tiene muchos
efectos nocivos para la salud humana, donde se puede destacar su implicación en
las enfermedades cardiovasculares y respiratorias y en el cáncer de pulmón [2,3].
Sin embargo, varios estudios científicos han demostrado que el tabaquismo
también afecta de forma negativa al sistema reproductivo, estando asociado a la
disminución de la fertilidad masculina [4,5].
Los resultados de varias
publicaciones han documentado efectos adversos del tabaquismo en los procesos
reproductivos (espermatogénesis), en parámetros del eyaculado (volumen,
concentración) y en la función de los espermatozoides (morfología, motilidad y
vitalidad), que a su vez y con el tiempo, afectan a la fertilidad masculina [1,6].
Además, el humo del tabaco se considera un disruptor endocrino. Así mismo, se
ha demostrado que también provoca un aumento de la fragmentación del ADN
espermático, mutaciones y aneuploidías en los espermatozoides, lo cual afecta
de forma negativa a la fertilidad masculina (Figura 1) [6].
2. MECANISMOS POR LOS QUE EL TABACO AFECTA A LA FERTILIDAD MASCULINA
Se ha observado que la inhalación
del humo del tabaco provoca un aumento de la formación de especies reactivas de
oxígeno (ROS) y, por consiguiente, el desarrollo de estrés oxidativo [6].
La acumulación excesiva de ROS provoca la peroxidación de los lípidos y roturas
de la cadena del ADN [7,8],
lo cual altera los parámetros espermáticos y las funciones de los
espermatozoides. Así mismo, se ha visto que la presencia excesiva de ROS
provoca el incremento de los niveles de las citoquinas proapoptóticas, lo que
puede conducir a un elevado daño en el ADN de los espermatozoides y, en última
instancia, a un deterioro de la fertilidad masculina [9].
Además, cabe destacar que en el suero de los hombres que consumen tabaco hay un
aumento de la secreción de citoquinas inflamatorias, lo que a su vez, eleva aún
más la formación de las ROS [10].
Por otro lado, como se ha
mencionado anteriormente, los sustratos del humo del tabaco actúan como
disruptores endocrinos, ya que pueden inhibir la secreción de las hormonas
folículo estimulante (FSH) y luteinizante (LH) desde la hipófisis anterior, lo
cual afecta a la síntesis de testosterona y a la espermatogénesis. Además,
algunos de estos tóxicos tienen la capacidad de atravesar la barrera
hemato-testicular, afectando así de forma directa a la producción y/o secreción
de la testosterona y a la espermatogénesis [6].
Así mismo, se ha observado que el humo del tabaco también tiene un impacto
negativo en el proceso de protaminación a través de la alteración de P2, lo que
lleva a un cambio en la relación P1/P2, afectando de esta forma a la
funcionalidad espermática [1,11].
En la Figura 2 se muestran de forma
resumida las vías por las que el tabaco puede afectar a la fertilidad
masculina.
Figura 2. Mecanismos por los que el humo del tabaco afecta a la fertilidad masculina [6].
2.1. Influencia del tabaco en la protaminación espermática
Las protaminas son las nucleoproteínas más abundantes en el espermatozoide maduro. En los seres humanos se pueden distinguir dos tipos de protaminas: la protamina 1 (P1) y la protamina 2 (P2) [12]. Durante la espermatogénesis las histonas se someten a metilación, fosforilación y ubiquitinación en sitios específicos, lo que facilita su sustitución por histonas específicas de los testículos durante la meiosis. La hiperacetilación de H4-t es un factor clave en la relajación de la espiral de ADN para facilitar la sustitución de las histonas específicas de los testículos por las proteínas de transición, mientras que la topoisomerasa 1 alivia la tensión de torsión provocando roturas de la doble cadena que posteriormente se vuelven a ligar. Más tarde, estas proteínas de transición se sustituyen por protaminas durante la fase de elongación de los espermatozoides (Figura 3).
Figura 3.
Diagrama que destaca los acontecimientos clave que ocurren durante la
transición de las histonas por protaminas [12]. |
Los genes de las protaminas se expresan
en el estadío de espermátida redonda, sin embargo, los productos de
transcripción se almacenan en las células haploides tempranas y no se activan
hasta el estadío de espermátida elongada [12].
Este patrón estadío-específico de expresión génica de las protaminas es
esencial para el correcto intercambio secuencial de nucleoproteínas y la
completa diferenciación de las espermátidas redondas en espermatozoides maduros
[13].
En los espermatozoides humanos,
la tasa de intercambio de histona a protamina es de aproximadamente un 85%, y
se estima que la relación P1 y P2 es de aproximadamente 1:1 [13].
Sin embargo, se han observado menores tasas de intercambio de histona a
protamina y expresión alterada de protaminas en los individuos infértiles [14,15].
Por otro lado, también se ha demostrado que una anómala relación P1/P2 está
relacionada con la disminución de los parámetros espermáticos, como la
concentración, la motilidad y la morfología de los espermatozoides, afectando a
su vez, a la fertilidad masculina [13].
Figura 4. Detección de la relación histona/protamina en el núcleo del espermatozoide mediante tinción con azul de anilina. Las flechas indican los espermatozoides con una elevada relación histona-protamina en (A) no fumadores normozoospermicos y (B) fumadores intensos astenozoospermicos [13].
|
Figura 5. Gráficos
que muestran la media, la mediana y el rango de los ratios P1/P2 de
pacientes fumadores y no fumadores. La relación P1/P2 es
significativamente mayor en los fumadores en comparación con los no
fumadores (1.34±0.46, 1.11±0.20, P < 0.010) [11]. |
Teniendo en cuenta la importancia de las protaminas en el mantenimiento de la integridad del ADN [12], una posible consecuencia de la expresión anormal de protaminas es la susceptibilidad de estos espermatozoides al daño del ADN. En la Figura 6 se puede observar que cuanto menor es la concentración de protaminas totales, mayor es el nivel de fragmentación del ADN. Además, se conoce que los pacientes con relaciones P1/P2 bajas tienen una fragmentación del ADN significativamente elevada en comparación con los pacientes con relaciones P1/P2 normales y altas (Figura 7) [16,17].

|
Figura 6. Correlación
entre el índice de fragmentación del ADN (DFI) y la concentración total de
protamina (Rs, -0,28, P <.001) [16]. |
|
Figura 7. Niveles
del índice de fragmentación del ADN (DFI) entre los pacientes con ratios
P1/P2 bajos, normales y altos [16]. |
3. ALTERACIONES GENÉTICAS Y EPIGENÉTICAS RELACIONADAS CON EL TABAQUISMO
Figura 8. Los mecanismos por los que el tabaquismo afecta a los parámetros y la calidad de los espermatozoides, incluidas las alteraciones genéticas y epigenéticas así como la formación de estrés oxidativo [19]. |
Los hidrocarburos aromáticos
policíclicos (PAH) son productos generados como resultado de la combustión
incompleta de materiales orgánicos. Los metabolitos como los PAH presentes en
el humo del tabaco pueden inducir una respuesta inflamatoria en el tracto
reproductivo masculino, lo que a su vez provoca la infiltración y el
reclutamiento de leucocitos en el semen, aumentando los niveles de ROS [18].
El benzo[a]pireno (BaP) es uno de
los PAH más estudiados que se encuentran en el humo del tabaco y es altamente
mutagénico y cancerígeno. La exposición al BaP provoca la hipometilación de los
loci LINE-1, SINE-B1 y SINE-B2 en los testículos [20].
Además, el BaP también puede provocar un aumento de la hiperactivación de los
espermatozoides, esencial para que adquieran capacidad fecundante, lo que da
lugar a una reacción acrosómica prematura y errónea [18].
Por otro lado, la exposición al
humo del tabaco puede dar lugar a la formación de aductos de ADN y proteínas
debido a las RNS y a los compuestos similares a las ROS [19].
Los PAH provocan un aumento de los niveles de ROS y forman aductos mediante la
unión covalente al ADN [18].
Siguiendo en esta línea, algunos estudios han demostrado la presencia de
niveles significativamente más altos de aductos de ADN en los espermatozoides
de las personas que consumen tabaco en comparación con aquellas que no lo
consumen [21].
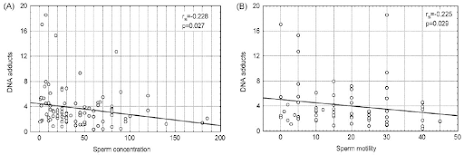
Además, se ha observado la existencia de una correlación negativa significativa
entre los aductos de ADN y la concentración (Figura 9A) y motilidad (Figura
9B) de los espermatozoides [21].
Así mismo, en otro estudio se ha evidenciado que estos aductos no siempre son
reparados por el ovocito, pudiéndose transmitir al cigoto [22].
Figura 9. (A) Correlación entre los niveles de aductos de ADN en los espermatozoides y la concentración de espermatozoides (cantidad de espermatozoides × 106 ml-1). (B) Correlación entre los niveles de aductos de ADN y la motilidad de los espermatozoides (porcentaje de espermatozoides que tienen un movimiento rápido) [21].
3.2. Aneuploidías cromosómicas
En un estudio en el que se evaluó
la conexión entre las aneuploidías y el consumo de tabaco, se encontró una
frecuencia significativamente mayor de la disomía del cromosoma 13 en los
espermatozoides de los fumadores en comparación con los de los no fumadores con
estilos de vida y características demográficas similares; sin embargo, no se
observó ninguna variación de disomía 21, X o Y entre los dos grupos. Además, se
vió que los fumadores “ligeros” tienen una frecuencia media de disomía XY
significativamente menor que los no fumadores. Las frecuencias de las
aneuploidías de los cromosomas sexuales resultaron ser más elevadas que las
aneuploidías autosómicas de los cromosomas 13 y 21. Debido a esto, se ha
propuesto que los cromosomas sexuales y el cromosoma 21 de los espermatozoides
humanos son más propensos a la no disyunción que otros cromosomas autosómicos [23].
Según otro estudio, donde se evaluó el efecto del tabaquismo sobre los niveles de las disomías de los cromosomas 3, X e Y en espermatozoides procedentes de hombres fumadores con cariotipo somático normal, se demostró que no había ninguna diferencia en la frecuencia de las disomías XX e YY entre los fumadores y los no fumadores; sin embargo, la disomía total de los cromosomas 3, X e Y resultó ser mayor en los fumadores que en los no fumadores. Además, el estudio mostró un aumento estadísticamente significativo de la disomía de los cromosomas X, Y y, en particular, del 3 en el grupo de fumadores en comparación con el grupo control de no fumadores. Así mismo, se detectó que la frecuencia de espermatozoides diploides XY33 era mayor que la frecuencia de espermatozoides diploides XX33 e YY33, lo que indica la importancia de algunos agentes exógenos en la meiosis I [24]. Además de las aneuploidías previamente mencionadas, en la Tabla 1 se recogen resultados de otros estudios sobre otras aneuploidías cromosómicas inducidas por el tabaquismo.
Aunque los mecanismos subyacentes siguen sin definirse, se conoce que algunos hombres tienen mayor susceptibilidad que otros a la no disyunción meiótica inducida por el tabaquismo, lo que sugiere que podría haber una variación genética y/o un componente epigenético [23]. Además de la no disyunción, la disminución o ausencia de recombinación meiótica puede elevar la frecuencia de aneuploidía en los espermatozoides y provocar infertilidad [25].
Tabla 1. Aneuploidías cromosómicas en espermatozoides humanos inducidas por el tabaquismo [18].
3.3. Metilación del ADN
La epigenética es el estudio de
las modificaciones hereditarias mitóticas y/o meióticas que regulan la
actividad del genoma sin afectar a las secuencias de ADN. La regulación
adecuada de los procesos epigenéticos, incluyendo la metilación del ADN, las modificaciones
de las histonas y las transiciones de las proteínas nucleares y los ARN no
codificantes durante el desarrollo gonadal y la espermatogénesis, es crucial
para el mantenimiento del desarrollo embrionario y la función normal de los
espermatozoides [18].
Se conoce que los espermatozoides
tienen una programación epigenética única [26],
y se ha propuesto que los componentes epigenómicos del espermatozoide se ven
afectados negativamente por el humo del tabaco, lo que puede dar lugar a una descendencia
con defectos de desarrollo [27].
Así mismo, las células somáticas del testículo implicadas en la regulación de
la espermatogénesis también sufren modificaciones epigenéticas [28].
La metilación del ADN es un tipo
de modificación epigenética del genoma, en la que se añade un grupo metilo a la
5ª posición de la citosina, situada en el dinucleótido citosina-fosfato-guanina
"CpGs" [29].
La metilación del ADN desempeña un papel vital en la regulación de la expresión
génica mediante la modulación de la transcripción del ADN en ARN y participa en
la protección de la integridad del genoma. El proceso de metilación del ADN
también puede verse alterado por muchos otros factores, como los genéticos y
los ambientales, de los que el tabaquismo es uno de los ejemplos más
destacables [1].
El análisis del metiloma de
muestras de espermatozoides de hombres fértiles ha demostrado que el perfil de
metilación de los espermatozoides es único, homogéneo e hipometilado. Además,
se ha descubierto que los genes con promotores hipometilados tienen ciertas
funciones en la espermatogénesis y en el desarrollo embrionario temprano [30].
Por este motivo, las alteraciones en los patrones de metilación del ADN de los
espermatozoides, que pueden estar tanto restringidas a un determinado locus o a
secuencias repetitivas como producirse de forma global, se han asociado a
parámetros anormales del semen y a la infertilidad [31].
En los últimos años, ha aumentado
de forma significativa el número de estudios en la literatura que investigan la
relación entre la metilación del ADN y el tabaquismo. Siguiendo en esta línea,
se han propuesto dos mecanismos con el fin de explicar las alteraciones
inducidas por el tabaquismo en la metilación [18].
Por un lado, las sustancias cancerígenas del humo del tabaco inducen una rotura
en la doble cadena del ADN; esta fractura se considera el punto de ignición de
los cambios en la metilación del ADN [32].
Por otro lado, el monóxido de carbono, uno de los componentes principales del
humo del tabaco, conduce a la hipoxia, que a su vez provoca la reducción de la
metionina adenosiltransferasa2A, responsable de la síntesis de
S-adenosilmetionina, un donante de grupos metilo para la metilación del ADN [33].
Un estudio sobre el genoma
completo determinó un perfil de metilación del ADN consistentemente alterado
tanto dentro de regiones genómicas específicas (incluyendo islas CpG definidas),
como alteraciones aleatorias de metilación del ADN en espermatozoides de 78
individuos fumadores en comparación con 78 individuos no fumadores. Los datos
de este estudio mostraron 141 CpGs diferencialmente metilados asociados con el
tabaquismo y un aumento de la metilación del ADN en todo el genoma en los
espermatozoides de los hombres que consumían tabaco en comparación con los que
nunca habían consumido. Además, este estudio sugiere que los cambios en los
patrones de metilación del ADN paterno inducidos por el tabaquismo podrían
introducir un mayor riesgo para la salud de la descendencia [34].
4. Polimorfismos genéticos y susceptibilidad
El hecho de que no todas las
personas que consumen tabaco sean infértiles, sugiere que las variaciones
genéticas o los polimorfismos en los genes de la reparación del ADN, la
apoptosis y el metabolismo de los xenobióticos entre los individuos
consumidores de tabaco pueden aumentar la susceptibilidad a la infertilidad. En
concreto, los polimorfismos y/o variaciones genéticas en los genes del
metabolismo de los xenobióticos (por ejemplo, NAT2, GSTM1, GSTT1, GSTP1 y
CYP1A1) y en los genes de reparación del ADN (OGG1) pueden elevar la
susceptibilidad a la infertilidad en los fumadores [19].
Siguiendo en esta línea, se ha
descubierto que las variantes genéticas de los genes del metabolismo de los
xenobióticos implicados en la desintoxicación de compuestos endo y/o exógenos
están asociadas al tabaquismo en los hombres infértiles. Las glutation
S-transferasas (GST), isoenzimas de GSTM1, GSTT1 y GSTP1, son los principales
sistemas antioxidantes defensivos contra el estrés oxidativo y reducen las ROS
a metabolitos menos reactivos para proteger el organismo [35].
Estudios previos han demostrado que el genotipo GSTP1 105IV está asociado con un mayor riesgo de infertilidad masculina. Por otro lado, las combinaciones de los genotipos GSTP1 105II/ GSTT1 del (G1), GSTM1 del/GSTT1 del (G2) y GSTM1 + /GSTT1 del (G3) están relacionadas con un menor riesgo de infertilidad masculina, mientras que la combinación de los genotipos GSTP1 105IV/GSTT1 + (G4) está asociada con un mayor riesgo. Así mismo, se ha observado que las combinaciones de los genotipos G3 y G4 están asociadas de forma significativa con la infertilidad en los hombres fumadores [35]. Por tanto, los genes GSTM1, GSTT1 y GSTP1 están implicados colectivamente en el desarrollo de la infertilidad masculina idiopática y sus efectos fenotípicos sobre el riesgo de esta enfermedad se ven potenciados por el consumo de tabaco.
5. CONCLUSIONES
- El tabaquismo afecta de forma negativa al sistema reproductivo
masculino y se asocia a la disminución de la fertilidad masculina, ya que
provoca efectos adversos tanto en la espermatogénesis, volumen del eyaculado,
concentración y morfología de los espermatozoides, como en su motilidad y
vitalidad.
- Una de las causas principales por las que el tabaco afecta a la
fertilidad masculina es por el gran incremento en la formación de ROS como
consecuencia de inhalar el humo del tabaco, ya que su acumulación en exceso
provoca la peroxidación lipídica y roturas de la cadena del ADN de los espermatozoides.
- Además, el humo del tabaco es un disruptor endocrino que inhibe la
secreción de FSH y LH desde la hipófisis anterior, lo cual afecta a la síntesis
de testosterona y a la espermatogénesis.
- Así mismo, se ha observado que el humo del tabaco también tiene
un impacto negativo en el proceso de protaminación a través de la alteración de
P2, lo que lleva a un cambio en la relación P1/P2, afectando de esta forma a
los parámetros espermáticos como la concentración, motilidad y morfología.
- Por otro lado, los intermedios
reactivos como ROS y RNS que se producen por el consumo de tabaco pueden
inducir múltiples cambios genéticos y epigenéticos, como la formación de
aductos de ADN y proteínas, anomalías cromosómicas, metilación del ADN, etc.
- Por último, cabe destacar que no todas las personas que consumen tabaco son infértiles, lo que sugiere la existencia de variaciones genéticas o polimorfismos en los genes de reparación del ADN, apoptosis y metabolismo de xenobióticos entre estos individuos, aumentando o disminuyendo su susceptibilidad a la infertilidad.
REFERENCIAS
[1] Y. Alkhaled, M. Laqqan, S. Tierling, C.
Lo Porto, H. Amor, M.E. Hammadeh, Impact of cigarette-smoking on sperm DNA
methylation and its effect on sperm parameters, Andrologia. 50 (2018) 1-12.
https://doi.org/10.1111/and.12950.
[2] T. Hendriks, R. van Dijk,
N.A. Alsabaan, P. van der Harst, Active Tobacco Smoking Impairs Cardiac
Systolic Function, Sci. Rep. 10 (2020) 1-6.
https://doi.org/10.1038/s41598-020-63509-3.
[3] T. Walser, X. Cui, J.
Yanagawa, J.M. Lee, E. Heinrich, G. Lee, S. Sharma, S.M. Dubinett, Smoking and
Lung Cancer: The Role of Inflammation, Proc. Am. Thorac. Soc. 5 (2008) 811-815.
https://doi.org/10.1513/pats.200809-100TH.
[4] R. Sharma, A. Harlev, A.
Agarwal, S.C. Esteves, Cigarette Smoking and Semen Quality: A New Meta-analysis
Examining the Effect of the 2010 World Health Organization Laboratory Methods
for the Examination of Human Semen, Eur. Urol. 70 (2016) 635-645.
https://doi.org/10.1016/j.eururo.2016.04.010.
[5] D. Pizzol, C. Foresta, A.
Garolla, J. Demurtas, M. Trott, A. Bertoldo, L. Smith, Pollutants and sperm
quality: a systematic review and meta-analysis, Environ. Sci. Pollut. Res. 28
(2021) 4095-4103. https://doi.org/10.1007/s11356-020-11589-z.
[6] T.S. Omolaoye, O. El
Shahawy, B.T. Skosana, T. Boillat, T. Loney, S.S. du Plessis, The mutagenic
effect of tobacco smoke on male fertility, Environ. Sci. Pollut. Res. (2021)
1-12. https://doi.org/10.1007/s11356-021-16331-x.
[7] S. Roychoudhury, A.
Agarwal, G. Virk, C.L. Cho, Potential role of green tea catechins in the
management of oxidative stress-associated infertility, Reprod. Biomed. Online.
34 (2017) 487-498. https://doi.org/10.1016/j.rbmo.2017.02.006.
[8] T. Fullston, N.O.
McPherson, D. Zander-Fox, M. Lane, The most common vices of men can damage
fertility and the health of the next generation, J. Endocrinol. 234 (2017) 1-6.
https://doi.org/10.1530/JOE-16-0382.
[9] X. Cui, X. Jing, X. Wu,
Z. Wang, Q. Li, Potential effect of smoking on semen quality through DNA damage
and the downregulation of Chk1 in sperm, Mol. Med. Rep. 14 (2016) 753-761.
https://doi.org/10.3892/mmr.2016.5318.
[10] S.-R. Yang, A.S. Chida,
M.R. Bauter, N. Shafiq, K. Seweryniak, S.B. Maggirwar, I. Kilty, I. Rahman,
Cigarette smoke induces proinflammatory cytokine release by activation of NF-κB
and posttranslational modifications of histone deacetylase in macrophages, Am.
J. Physiol. Cell. Mol. Physiol. 291 (2006) L46-L57.
https://doi.org/10.1152/ajplung.00241.2005.
[11] M. Hammadeh, M. Hamad, M.
Montenarh, C. Fischer-Hammadeh, Protamine contents and P1/P2 ratio in human
spermatozoa from smokers and non-smokers, Hum. Reprod. 25 (2010) 2708-2720.
https://doi.org/10.1093/humrep/deq226.
[12] D.T. Carrell, B.R. Emery,
S. Hammoud, Altered protamine expression and diminished spermatogenesis: what
is the link?, Hum. Reprod. Update. 13 (2007) 313-327.
https://doi.org/10.1093/humupd/dml057.
[13] B. Yu, Y. Qi, D. Liu, X.
Gao, H. Chen, C. Bai, Z. Huang, Cigarette smoking is associated with abnormal
histone-to-protamine transition in human sperm, Fertil. Steril. 101 (2014)
51-57. https://doi.org/10.1016/j.fertnstert.2013.09.001.
[14] X. Zhang, M. San Gabriel,
A. Zini, Sperm Nuclear Histone to Protamine Ratio in Fertile and Infertile Men:
Evidence of Heterogeneous Subpopulations of Spermatozoa in the Ejaculate, J.
Androl. 27 (2006) 414-420. https://doi.org/10.2164/jandrol.05171.
[15] K. Steger, J. Wilhelm, L.
Konrad, T. Stalf, R. Greb, T. Diemer, S. Kliesch, M. Bergmann, W. Weidner, Both
protamine-1 to protamine-2 mRNA ratio and Bcl2 mRNA content in testicular
spermatids and ejaculated spermatozoa discriminate between fertile and
infertile men, Hum. Reprod. 23 (2007) 11-16.
https://doi.org/10.1093/humrep/dem363.
[16] V.W. Aoki, S.I. Moskovtsev,
J. Willis, L. Liu, J.B.M. Mullen, D.T. Carrell, DNA Integrity Is Compromised in
Protamine-Deficient Human Sperm, J. Androl. 26 (2005) 741-748.
https://doi.org/10.2164/jandrol.05063.
[17] A. García-Peiró, J.
Martínez-Heredia, M. Oliver-Bonet, C. Abad, M.J. Amengual, J. Navarro, C.
Jones, K. Coward, J. Gosálvez, J. Benet, Protamine 1 to protamine 2 ratio
correlates with dynamic aspects of DNA fragmentation in human sperm, Fertil.
Steril. 95 (2011) 105-109. https://doi.org/10.1016/j.fertnstert.2010.06.053.
[18] S. Gunes, A. Metin
Mahmutoglu, M.A. Arslan, R. Henkel, Smoking-induced genetic and epigenetic
alterations in infertile men, Andrologia. 50 (2018) 1-17.
https://doi.org/10.1111/and.13124.
[19] A. Harlev, A. Agarwal, S.O.
Gunes, A. Shetty, S.S. du Plessis, Smoking and Male Infertility: An
Evidence-Based Review, World J. Mens. Health. 33 (2015) 143-160.
https://doi.org/10.5534/wjmh.2015.33.3.143.
[20] R.W.L. Godschalk, N.
Verhofstad, M. Verheijen, C.L. Yauk, J.O. Linschooten, H. van Steeg, C.T. van
Oostrom, J. van Benthem, F.J. van Schooten, Effects of benzo[a]pyrene on mouse
germ cells: heritable DNA mutation, testicular cell hypomethylation and their
interaction with nucleotide excision repair, Toxicol. Res. (Camb). 4 (2015)
718-724. https://doi.org/10.1039/C4TX00114A.
[21] S. Horak, J. Polanska, P.
Widlak, Bulky DNA adducts in human sperm: relationship with fertility, semen
quality, smoking, and environmental factors, Mutat. Res. 537 (2003) 53-65.
https://doi.org/10.1016/S1383-5718(03)00051-2.
[22] J. Perrin, V. Tassistro, M.
Mandon, J.M. Grillo, A. Botta, I. Sari-Minodier, Tobacco consumption and
benzo(a)pyrene-diol-epoxide-DNA adducts in spermatozoa: In smokers, swim-up
procedure selects spermatozoa with decreased DNA damage, Fertil. Steril. 95
(2011) 2013-2017. https://doi.org/10.1016/j.fertnstert.2011.02.021.
[23] Q. Shi, E. Ko, L. Barclay,
T. Hoang, A. Rademaker, R. Martin, Cigarette smoking and aneuploidy in human
sperm, Mol. Reprod. Dev. 59 (2001) 417-421. https://doi.org/10.1002/mrd.1048.
[24] C.S. Pereira, M.S. Juchniuk
de Vozzi, S.A. dos Santos, M.A.C. Vasconcelos, C.C. de Paz, J.A. Squire, L.
Martelli, Smoking-induced chromosomal segregation anomalies identified by FISH
analysis of sperm, Mol. Cytogenet. 7 (2014) 58.
https://doi.org/10.1186/s13039-014-0058-7.
[25] C. Templado, L. Uroz, A.
Estop, New insights on the origin and relevance of aneuploidy in human
spermatozoa, MHR Basic Sci. Reprod. Med. 19 (2013) 634-643.
https://doi.org/10.1093/molehr/gat039.
[26] C.C. Boissonnas, P.
Jouannet, H. Jammes, Epigenetic disorders and male subfertility, Fertil.
Steril. 99 (2013) 624-631. https://doi.org/10.1016/j.fertnstert.2013.01.124.
[27] P. Esakky, K.H. Moley,
Paternal smoking and germ cell death: A mechanistic link to the effects of
cigarette smoke on spermatogenesis and possible long-term sequelae in
offspring, Mol. Cell. Endocrinol. 435 (2016) 85-93.
https://doi.org/10.1016/j.mce.2016.07.015.
[28] C. Guerrero-Bosagna, M.K.
Skinner, Environmental Epigenetics and Effects on Male Fertility, Adv Exp Med
Biol. 791 (2014) 67-81. https://doi.org/10.1007/978-1-4614-7783-9_5.
[29] A. Portela, M. Esteller,
Epigenetic modifications and human disease, Nat. Biotechnol. 28 (2010)
1057-1068. https://doi.org/10.1038/nbt.1685.
[30] C. Camprubí, R.A. Cigliano,
A. Salas-Huetos, N. Garrido, J. Blanco, What the human sperm methylome tells
us, Epigenomics. 9 (2017) 1299-1315. https://doi.org/10.2217/epi-2017-0049.
[31] R.G. Urdinguio, G.F. Bayón,
M. Dmitrijeva, E.G. Toraño, C. Bravo, M.F. Fraga, L. Bassas, S. Larriba, A.F.
Fernández, Aberrant DNA methylation patterns of spermatozoa in men with
unexplained infertility, Hum. Reprod. 30 (2015) 1014-1028.
https://doi.org/10.1093/humrep/dev053.
[32] J. Huang, M. Okuka, W. Lu,
J.C.M. Tsibris, M.P. McLean, D.L. Keefe, L. Liu, Telomere shortening and DNA
damage of embryonic stem cells induced by cigarette smoke, Reprod. Toxicol. 35
(2013) 89-95. https://doi.org/10.1016/j.reprotox.2012.07.003.
[33] Q. Liu, L. Liu, Y. Zhao, J.
Zhang, D. Wang, J. Chen, Y. He, J. Wu, Z. Zhang, Z. Liu, Hypoxia Induces
Genomic DNA Demethylation through the Activation of HIF-1α and
Transcriptional Upregulation of MAT2A in Hepatoma Cells, Mol. Cancer Ther. 10
(2011) 1113-1123. https://doi.org/10.1158/1535-7163.MCT-10-1010.
[34] T.G. Jenkins, E.R. James,
D.F. Alonso, J.R. Hoidal, P.J. Murphy, J.M. Hotaling, B.R. Cairns, D.T.
Carrell, K.I. Aston, Cigarette smoking significantly alters sperm DNA
methylation patterns, Andrology. 5 (2017) 1089-1099.
https://doi.org/10.1111/andr.12416.
[35] S.L. Yarosh, E. V.
Kokhtenko, M.I. Churnosov, M.A. Solodilova, A. V. Polonikov, Joint effect of
glutathione S-transferase genotypes and cigarette smoking on idiopathic male
infertility, Andrologia. 47 (2015) 980-986. https://doi.org/10.1111/and.12367.








Está muy bien hecho, muy completo a la vez que organizado y accesible. Buen trabajo.
ResponderEliminarMuchas gracias por tu opinión Felipe.
ResponderEliminarUn saludo.